의료기기 관련 인증제도
의료분야의 비즈니스 하기 좋은 도시! 대구가 글로벌 의료산업의 미래를 만들어갑니다.
HOME산업정보 및 동향의료기기 관련 인증제도
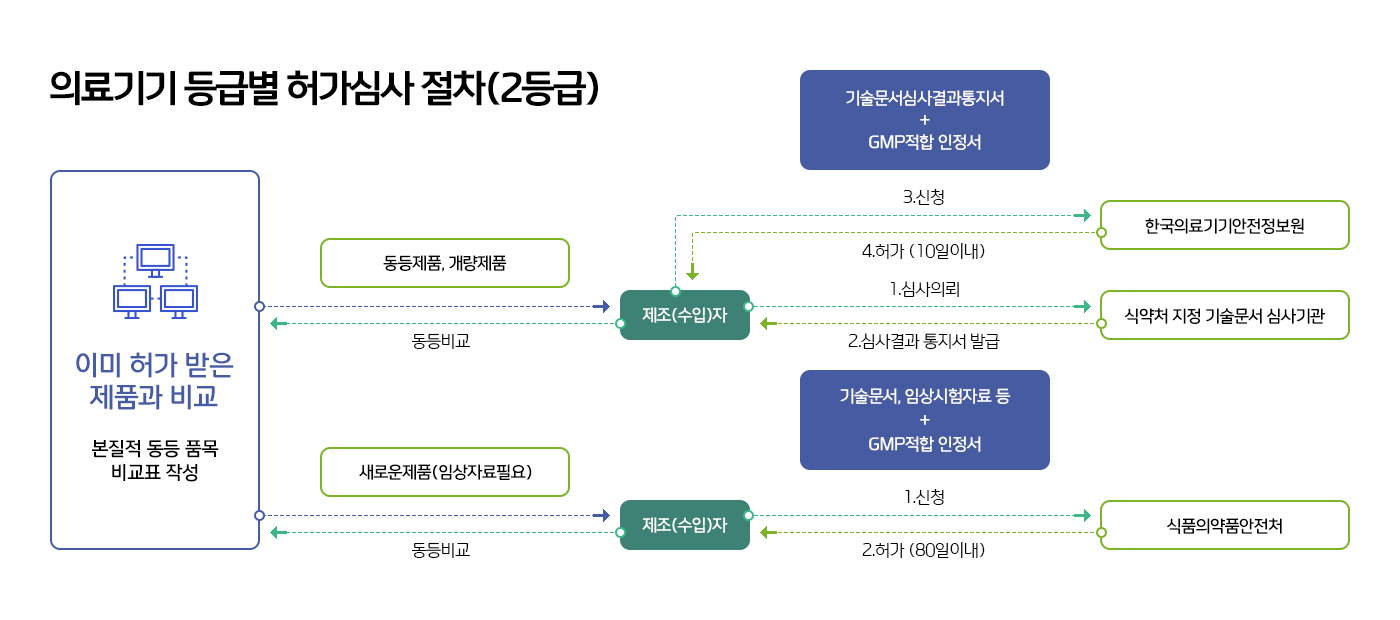
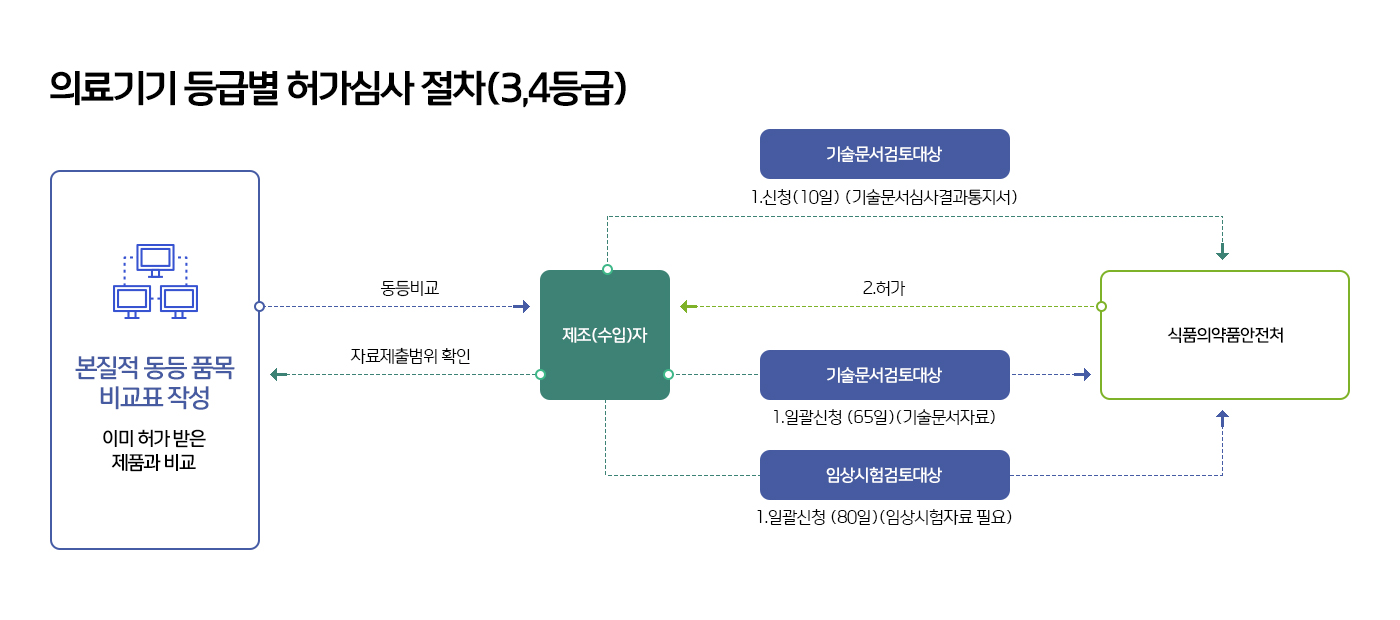
의료기기 허가 절차
의료기기 동등성 판단기준
| 제품 | 구분 | 사용목적 | 작용원리 | 원재료 | 성능 | 시험규격 | 사용방법 |
|---|---|---|---|---|---|---|---|
| 새로운 제품 | 전기 | ○또는● | ○또는● | X | ● | ○또는● | ○또는● |
| 용품 | ○또는● | ○또는● | ○또는● | ● | ○또는● | ○또는● | |
| 일부 다른(개량) 제품 | 전기 | ○ | ○ | X | ● | ○또는● | ○또는● |
| 용품 | ○ | ○ | ○ | ● | ○또는● | ○또는● | |
| 기허가 제품과 동등한 제품(동등) | 전기 | ○ | ○ | X | ○ | ○ | ○ |
| 용품 | ○ | ○ | ○ | ○ | ○ | ○ |
- 사용목적
- 당해 제품의 적응중, 효능 효과, 사용목적을 의미함
- 작용원리
- 당해 제품을 개발하기 위하여 적용한 물리화학적, 전기기계적 원리
* 작용원리가 다른 경우 예) 전동식으로 인체조직의 절개에 사용되는 '전동식의료용 칼' 이 물을 가압하여 인체조직의 절개에 사용될 수 있도록 적용한 경우를 말함 - 시험규격
- 당해 제품의 안전만을 검증하기 위해 적용한 시험규격 다만 전자혈압계 등 임상이 필요한 제품의 경우는 동등제품에서 제외
의료기기 허가 절차
![[의료기기 허가 절차 도식] 의료기기 해당 여부 및 품목&등급 확인은 식품의약품안전처와 질의 및 회신(10일 이내) 과정을 거침. 1.의료기기 제조(수입)업:신청 및 허가(25일 이내)를 지방식약청에 요청 / 2.1등급:신청 및 신고수리를 한국의료기기안전정보원에 요청 / 3.2등급:(가)동등공고제품-신청 및 인증(10일 이내) / (나)동등,개량제품-A.기술문서적합통지 후 식약처 지정 기술문서심사기관(25일 이내)을 거쳐 한국의료기기안전정보원 요청, B.신청 및 인증(10일 이내)을 한국의료기기안전정보원에 요청 / (다).새로운 제품:신청 및 인증(10일 이내)을 식약처에 요청 / 3.GMP적합 인정서 : 식약처 지정 GMP심사관을 거처 식약처에 요청 / 4.3ㆍ4등급:(가)기술문서 심사담당-신청 및 허가(65일 이내)는 식약처에 요청, (나)임상자료 심사대상-신청 및 허가(80일 이내) 식약처에 요청](/images/trend/2022/equipment_permission.jpg)
의료기기 유형별 절차
GMP 심사절차
- 의료기기 GMP 심사신청 접수
- 품질관리 심사기관에 신청서류를 제출하고 신청수수료를 납부합니다. 제출자료는 심사신청서, 외국제조원 총괄표 등을 GMP 심사기관에 제출합니다.
- 제조소 현장심사 일정 등 심사협의
- 품질관리심사기관과 본청인 식약처가 합동으로 심사합니다. 현장심사 대상여부를 판단하고 일정을 확인하고 심사팀을 구성합니다. 현장심사대상은 ① 신개발의료기기 제조기업, ② 최초 GMP 신청기업, ③ 3년 내 부적합 또는 안전성 유효성 문제 발생기업입니다.
- 일정 및 심사계획 통보
- 품질관리심사기관은 신청기업 앞으로 향후 일정 및 수수료, 출장경비 등에 대해 안내합니다. 식약청도 마찬가지이며 외국제조원인 경우 출장경비를 납입고지 합니다.
- GMP 서류 심사 실시
- 품질매뉴얼, 제품표준서, 외국제조원 GMP인증서 등을 검토합니다. 품목군 추가시 추가 품목군에 대한 시스템 반영여부, 외국 QMS 적합인증여부를 검토합니다.
- 현장심사
- 시설관리의 적절성, GMP시스템 수립(문서화), GMP 시스템 적용의 적절성 여부 등을 심사합니다.
- 결과통보
- 심사결과 적합한 경우 서면으로 결과통보하며(적합인정서 교부) 부적합한 경우도 공문으로 통보합니다. 보완필요시 30일 기한으로 보완요구를 하며 특별히 이에 대한 신청절차는 없습니다. 보완심사에서도 결과가 적합한 경우 적합인정서가 발행되며 부적합 시 부적합 통보를 하게 됩니다.
GMP 심사 종류
| 최초심사 |
제조 또는 수입의료기기가 GMP기준에 적합함을 인정받기 위해 최초로 받는 심사 GMP 시스템 구축 및 시설장비 구비 확인 |
|---|---|
| 정기 갱신심사 |
의료기기법 시행규칙 별표3 제6호 나목에 따라 3년에 1회 이상 받는 GMP적용실적에 대한 정기적인 심사 적합인정서 유효기간 만료일 90일 이전에 정기심사 신청 |
| 추가심사 |
GMP기준 별표3에 의거 다른 품목군의 의료기기를 추가하여 제조 또는 수입하고자 하는 경우 받는 심사 해당 품목군의 시설장비 구비, GMP시스템의 적절한 변경 등을 심사 |
| 변경심사 |
제조원의 소재지가 변경(이전)하는 경우 받는 심사. 다만, 제품의 품질과 관계가 적은 보관소·시험실의 변경은 제외됩니다. 이전에 따른 시설장비 구비, GMP시스템의 적절한 변경 등을 심사 |
참고자료
가이드
홍보물
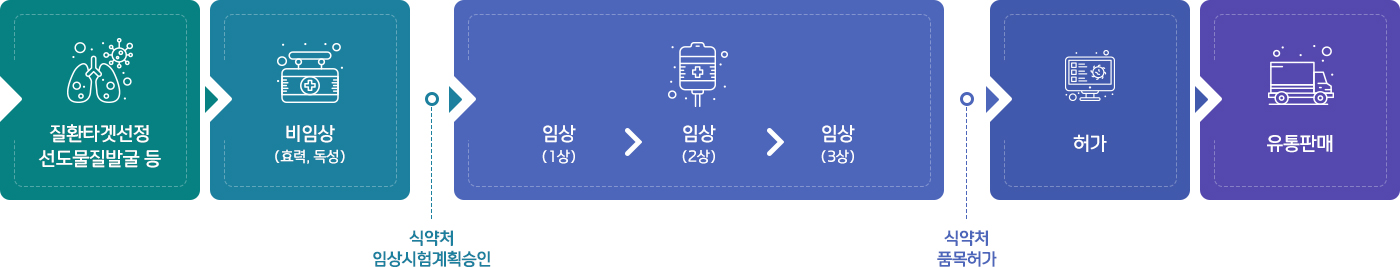
의약품 개발과정 및 구분
- 화학의약품
- 화학적으로 합성 또는 정제한 단일 화학물질 의약품
- 생물의약품 / 바이오의약품
- 생물학적제재(백신, 혈장분획제제, 항독소 등), 유전자제조합의약품, 세포배양의약품, 유전자치료제, 세포치료제
- 한약(생약)제제
- 동물 식물 광물에서 유래한 생약 생약추축물 하얀 한약제제
- 품목허가 대상
- 신약, 허가된 의약품이 없는 신규의약품, 안전성 · 유효성심사 대상 품목, 방사성의약품, 생물학적제제, 유전자재조합의약품, 세포배양의약품, 유전자치료제, 세포치료제, 인태반유래의약품, 특허목록등재 의약품, 국제공통기술문서(CTD) 작성 품목
- 품목신고 대상
- 대한민국약전 또는 식약처장이 인정하는 공정서, 의약품등 표준제조기준, 기허가 의약품과 동일한 품목(제네락의약품)
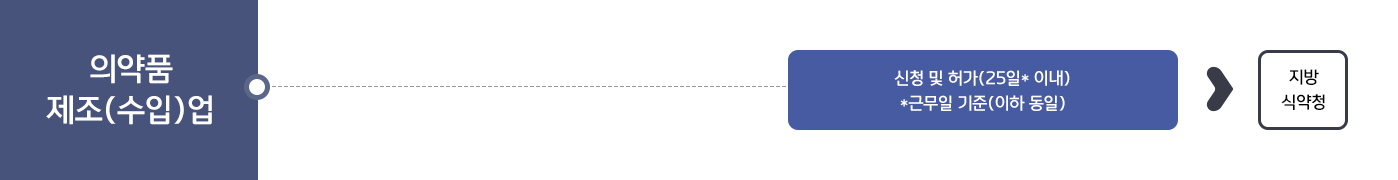
의약품 허가 · 신고 절차
가이드
- (의약품)첨단바이오의약품 자주묻는 질의응답집[민원인안내서](2022.3)
- (의약품)완제의약품 중심 허가·심사 운영 관리 방안 관련 질의응답집(민원인안내서)(2022.2)
- (의약품)예방용 mRNA 백신 평가 가이드라인(2022.1)
- (의약품)공중보건 위기대응 의약품 심사 가이드라인(2022.3)
- (의약품)개량신약 허가사례집(2개정)(2022.2)
- (의약품)줄기세포치료제 종양원성 평가 가이드라인(민원인안내서)(2022.3)
- (의약품)코로나19 치료제 in vitro 효력시험법(민원인안내서) (2022.3)
- (의약품)의약품+신속심사+보고서-게시용(2022.9) new





![[전기사용 의료기기] 1.기본원리 / 2.개념정립(기술 개념 및 응용분야 정립) and 3.개념검증(특허출원) (가)지적재산권 확보:특허,논문 (나)의료기기 품목 및 등급 확인:사용목적, 작용원리 등 검토,식약처 전자민원 창구 활용,(의료기기 해당여부 검토 민원신청) (다)동등성 비교:사용목적, 작용원리, 성능.시험규격. 사용방법 비교,임상시험 여부 확인 (라)신의료기술 해당 여부:기존기술 해당여부 질의 및 답변 확보 / 4.시작품 설계, 제작 (가)시작품 제작:디자인, 설계(SW. HW),시작품 제작 완료 (나)설계 검토 진행:법령 및 규정 요구사항 확인 / 5.시작품 성능평가(비임상포함) (가)시작품 디버깅 및 최종 디자인 확정:평가 후 디버깅,디버깅 결과를 반영한 시작품 제작 (나)시작품 성능 및 안전성 평가:성능 및 안전성평가 요구사항 검토,(시작품)성능 및 안전성 확인평가 실시,사이버보안 계획 수립 (다)사용적합성 계획:사용적합성 계획 수립 (라)품질시스템(GMP) 구축:GMP 풍질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,특수공정(열균, 포장 등)에 대한 밸리데이션,SW 검증 및 유효성 확인,제품 매뉴얼 작성 / 6.시제품 설계, 제작, 성능평가 (가)시제품 제작:디자인, 설계(SW. HW),시제품 제작 완료 (나)시제품 디버깅 및 최종 디자인 확정:평가 후 디버깅,디버깅 결과를 반영한 시제품 제작 (다)성능평가 준비 및 실시:성능 및 안전성평가,요구사항 확정 시험 관련 자료 준비(부품 인증서 등),(시제품)성능 및 안전성 확인평가 실시, 사이버보안 적용 및 수행 (라)사용적합성 형성평가:사용적합성 형성평가 수행 (마)품질시스템(GMP) 구축:GMP 풍질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,특수공정(열균, 포장 등)에 대한 밸리데이션,SW 검증 및 유효성 확인,제품 매뉴얼 작성 / 7.비임상시험(GLP) 안전성 및 유효성 평가(GLP 포함 비임상) (가)의료기기 허가 준비:기술문서 초안 작성, (나)법령 및 규정에 적합한 공인시험성적서 준비 및 확보:전기기계적 안전에 관한 자료,전자파 안전에 관한 자료,성능에 관한 자료,소프트웨어 적합성 확인보고서,방사선에 관한 안전성 자료 (다)동물실험:유효성 평가 (라)사용적합성 총괄평가 수행:사용적합성 결과 보고서 확보 (마)품질시스템(GMP) 인증:GMP 인증 획득,위험관리 보고서,SW V&V 보고서(소프트웨어 검증 및 유효성 확인자료) / 8-1.임상 시험 (가)임상시험 준비:임상시험계획서 관련 자료 준비,임상시험계획서 작성,IRB 준비,임상시험계획서 신청(임상시험계획서,GMP적합인정서,기술문서에 관한 자료),임상시험계획서 승인,IRB 신청,IRB 승인,임상시험 수행 시작 (나)임상시험 실시 및 종료:시험 모니터링,시험 종료, 종료보고,IRB 종료보고,IRB 결과보고서 승인 / 8-2.인허가/보험등재 (가)의료기기 허가 준비:기술문서 최종안 작성,허가 관련 보고서 검토 및 확보 (이미 허가인증 받은 제품과 비교한 자료,사용목적에 관한 자료,작용원리에 관한 자료,기원 또는 발견 및 개발 경위에 관한 자료,임상시험에 관한 자료,외국의 사용현황 등에 관한 자료) (나)의료기기 허가:의료기기 허가 신청,기술문서 심사,의료기기 허가 승인 (다)신의료기술평가 및 보험:신의료기술평가,보험 등재 / 9.양산](/images/trend/pop-01.jpg)
![[소프트웨어 의료기기(SaMD)] 1.기본원리 / 2.개념정립 기술 개념 및 응용분야 정립 and 3.개념검증 특허출원/기본성능 검증 (가)지적재산권 확보:특허,논문 (나)DB 확보 및 구축:전자의무기록, 의료영상 등 DB 확보 (다)의료기기 풍옥 및 등급 확인:사용목적, 작용원리 등 검토,식약처 전자민원 창구 활용(의료기기 해당여부 검토민원신청) (라)동등성 비교:사용목적, 작용원리, 성능.시험규격, 사용방법 비교,임상시험 여부 확인 (마)신의료기술 해당 여부:기존기술 해당여부 질의 및 답변 확보 / 4.시작품 설계,제작 (가)시작품(a 테스트 버전) 제작:SW 모듈 설계 및 검증,시작품 제작 완료 (나)소프트웨어 형태 및 등급 설정:내장형, 독립형,안전성 등급(A. B. C) / 5.시작품 성능평가(비임상포함) (가)시작품 성능 및 안전성 평가:성능 및 안전성 평가 요구사항 검토,(시작품)성능 및 안전성 확인 평가 실시,사이버보안 계획 수립 (나)사용적합성 계획:사용적합성 계획 수립 (다)품질시스템(GMP) 구축:GMP 품질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,SW 검증 및 유효성 확인,제품 매뉴얼 작성 / 6.시작품 설계,제작,성능평가 (가)시제품(베타 테스트 버전) 제작:SW 모듈 수정 및 검증,시제품 제작 완료 (나)성능평가 준비 및 실시:성능 및 안전성평가 요구사항 확정,(시제품)성능 및 안전성 확인평가 실시,사이버보안 적용 및 수행 (다)사용적합성 형성평가:사용적합성 형성평가 수행 (라)품질시스템(GMP) 구축:GMP 품질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,SW 검증 및 유효성 확인,제품 매뉴얼 작성 / 7.비임상시험(GLP) 안전성 및 유효성 평가 (GLP 포함 비임상) (가)의료기기 허가 준비:기술문서 초안 작성 (나)법령 및 규정에 적합한 공인시험성적서 준비 및 확보:소프트웨어 적합성 확인보고서 (다)사용적합성 총괄평가 수행:사용적합성 결과 보고서 확보 (라)품질시스템(GMP) 인증:GMP 인증 획득,위험관리 보고서,SW V&V 보고서 (소프트웨어 검증 및 유효성 확인 자료) / 8-1.임상시험 (가)임상시험 준비:임상시험계획서 관련 자료 준비,임상시험계획서 작성,IRB 준비,임상시험계획서 신청(임상시험계획서,GMP적합인정서,기술문서에 관한 자료),임상시험계획서 승인,IRB 신청,IRB 승인,임상시험 수행 시작 (나)임상시험 실시 및 종료:시험 모니터링,시험 종료, 종료보고,IRB 종료보고,IRB 결과보고서 승인 / 8-2.인허가/보험등재 (가)의료기기 허가 준비:기술문서 최종안 작성,허가 관련 보고서 검토 및 확보 (이미 허가인증 받은 제품과 비교한 자료, 사용목적에 관한 자료,작용원리에 관한 자료,기원 또는 발견 및 개발 경위에 관한 자료,임상시험에 관한 자료,외국의 사용현황 등에 관한 자료) (나)의료기기 허가:의료기기 허가 신청,기술문서 심사,의료기기 허가 승인 (다)신의료기술평가 및 보험:신의료기술평가,보험 등재 / 9.양산](/images/trend/pop-02.jpg)
![[체외진단 의료기기(시약)] 1.기본원리 / 2.개념정리 및 기술 개념 및 응용분야 정립 and 3.개념검증 특허출원/기본성능 검증 (가)지적재산권 확보:특허,논문 (나)의료기기 품목 및 등급 확인:사용목적, 작용원리 등 검토,식약처 전자민원 창구 활용(의료기기 해당여부 검토 민원신청) (다)동등성 비교:사용목적, 작용원리, 원재료,성능 비교, 임상적 성능시험 여부 확인 (라)신의료기술 해당 여부:기존기술 해당여부 질의 및 답변 확보 / 4.시작품 설계,제작 (가)시작품 제작:관련 국제표준,요구사항 파악,의도한 사용자 요구사항 식별,검체보관 및 취급(온도, 습도 등) 조건 설정 / 5.시작품 성능평가(비임상포함) (가)시작품 성능 및 안전성 평가:성능 및 안전성 평가 요구사항 검토,(시작품)성능 및 안전성 확인평가 실시 (나)품질시스템(GMP) 구축:GMP 품질문서 작성,특수공정(열균, 포장 등)에 대한 밸리데이션,제품 매뉴얼 작성 / 6.시제품 설계,제작,성능평가 (가)시제품 제작:시제품 제작 완료 (나)성능평가 준비 및 실시:성능 및 안전성평가 요구사항 확정,시험 관련 자료 준비(부품 인증서 등),(시제품)성능 및 안전성 확인평가 실시 (다)품질시스템(GMP) 구축:GMP 품질문서 작성,특수공정(열균, 포장 등)에 대한 밸리데이션,제품 매뉴얼 작성 / 7.비임상시험(GLP) 안전성 및 유효성 평가 (GLP 포함 비임상) (가)의료기기 허가 준비:기술문서 초안 작성 (나)법령 및 규정에 적합한 공인시험성적서 준비 및 확보:분석적 성능시험에 관한 자료,임상적 성능시험에 관한 자료,품질관리 시험에 관한 자료,저장방법과 사용기간 또는 유효기간에 관한 자료,표준물질 및 검체에 관한 자료 (다)품질시스템(GMP) 인증:GMP 인증 획득,위험관리 보고서 / 8-1.임상시험 (가)임상시험 준비:임상시험계획서 관련 자료 준비,임상시험계획서 작성,IRB 준비,임상시험계획서 신청(임상시험계획서,GMP적합인정서,기술문서에 관한 자료),임상시험계획서 승인,IRB 신청,IRB 승인,임상시험 수행 시작 (나)임상시험 실시 및 종료:시험 모니터링,시험 종료, 종료보고,IRB 종료보고,IRB 결과보고서 승인 / 8-2.인허가/보험등재 (가)의료기기 허가 준비:기술문서 최종안 작성,허가 관련 보고서 검토 및 확보 (이미 허가인증 받은 제품과 비교한 자료, 기원·개발경위에 관한 자료, 검출 또는 측정 원리·방법에 관한 자료, 국내외 사용현황에 관한 자료, 원재료 및 제조방법에 관한 자료, 사용목적에 관한 자료, 취급자 안전에 관한 자료) (나)의료기기 허가:의료기기 허가 신청,기술문서 심사,의료기기 허가 승인 (다)신의료기술평가 및 보험:신의료기술평가,보험 등재 / 9.양산](/images/trend/pop-03.jpg)
![[체외진단 의료기기(장비)] 1.기본원리 / 2.개념정립 기술 개념 및 응용분야 정립 and 3. 개념검증 특허출원/기본성능 검증 (가)지적재산권 확보:특허,논문 (나)의료기기 품목 및 등급 확인:사용목적, 작용원리 등 검토,식약처 전자민원 창구 활용(의료기기 해당여부 검토 민원신청) (다)동등성 비교:사용목적, 작용원리, 성능,시험규격, 사용방법 비교,임상적 성능시험 여부 확인 (라)신의료기술 해당 여부:기존기술 해당여부 질의 및 답변 확보 / 4.시작품 설계,제자 (가)시작품 제작:디자인, 설계(SW. HW),시작품 제작 완료 (나)설계 검토 진행:법령 및 규정 요구사항 확인 (다)검증 전략 수립:성능 시험항목 설정 / 5.시작품 성능평가(비임상포함) (가)시작품 디버깅 및 최종 디자인 확정:평가 후 디버깅,디버깅 결과를 반영한 시작품 제작 (나)시작품 성능 및 안전성 평가:성능 및 안전성 평가 요구사항 검토,(시작품)성능 및 안전성 확인 평가 실시,사이버보안 계획 수립 (다)사용적합성 계획:사용적합성 계획 수립 (라)품질시스템(GMP) 구축:GMP 품질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,특수공정(일균, 포장 등)에 대한 밸리데이션,SW 검증 및 유효성 확인,제품 매뉴얼 작성 / 6.시제품 설계, 제작, 신청 (가)시제품 제작:디자인, 설계(SW. HW),시제품 제작 완료 (나)시제품 디버깅 및 최종 디자인 확정:평가 후 디버깅,디버깅 결과를 반영한 시제품 제작 (다)성능평가 준비 및 실시:성능 및 안전성평가 요구사항 확정,시험 관련 자료 준비(부품 인증서 등),(시제품)성능 및 안전성 확인평가 실시,사이버보안 적용 및 수행 (라)사용적합성 형성평가:사용적합성 형성평가 수행 (마)품질시스템(GMP) 구축:GMP 품질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,특수공정(일균, 포장 등)에 대한 밸리데이션,SW 검증 및 유효성 확인,제품 매뉴얼 작성 / 7.비임상시험(GLP) 안전성 및 유효성 평가 (GLP 포함 비임상) (가)의료기기 허가 준비:기술문서 초안 작성 (나)법령 및 규정에 적합한 공인시험성적서 준비 및 확보:전기기계적 안전에 관한 자료,전자파 안전에 관한 자료,성능에 관한 자료,소프트웨어 적합성 확인보고서,방사선에 관한 안전성 자료 (다)사용적합성 총괄평가 수행:사용적합성 결과 보고서 확보 (라)품질시스템(GMP) 인증:GMP 인증 획득,위험관리 보고서,SW V&V 보고서(소프트웨어 검증 및 유효성 확인 자료) / 8-1.임상시험 (가)임상시험 준비:임상시험계획서 관련 자료 준비,임상시험계획서 작성,IRB 준비,임상시험계획서 신청(임상시험계획서,GMP적합인정서,기술문서에 관한 자료),임상시험계획서 승인,IRB 신청,IRB 승인,임상시험 수행 시작 (나)임상시험 실시 및 종료:시험 모니터링,시험 종료,종료보고,IRB 종료보고,IRB 결과보고서 승인 / 8-2.인허가/보험등재 (가)의료기기 허가 준비:기술문서 최종안 작성,허가 관련 보고서 검토 및 확보 (이미 허가인증 받은 제품과 비교한 자료, 사용목적에 관한 자료,작용원리에 관한 자료,기원 또는 발견 및 개발 경위에 관한 자료,임상적 성능시험에 관한 자료, 외국의 사용현황 등에 관한 자료) (나)의료기기 허가:의료기기 허가 신청,기술문서 심사,의료기기 허가 승인 (다)신의료기술평가 및 보험:신의료기술평가,보험 등재 / 9.양산](/images/trend/pop-04.jpg)
![[전기미사용 의료기기] 1.기본원리 / 2.개념정립 기술 개념 및 응용분야 정립 and 3.개념검증 특허출원/기본성능 검증 (가)지적재산권 확보:특허,논문 (나)원재료 검토:물리화학적 정보 확인,원자재 특성 분석 (다)의료기기 품목 및 등급 확인:사용목적, 작용원리 등 검토,식약처 전자민원 창구 활용(의료기기 해당여부 검토 민원신청) (라)동등성 비교:사용목적, 작용원리, 원재료, 성능,시험규격, 사용방법 비교,임상시험 여부 확인 (마)신의료기술 해당 여부:기존기술 해당여부 질의 및 답변 확보 / 4.시작품 설계,제작 (가)시작품 제작:디자인. 설계,시작품 제작 완료 (나)설계 검토 진행:법령 및 규정 요구사항 확인 (다)검증 전략 수립:성능 시험항목 설정 / 5.시작품 성능평가(비임상포함) (가)시작품 성능 및 안전성 평가:성능 및 안전성 평가 요구사항 검토,(시작품)성능 및 안전성 확인평가 실시 (나)사용적합성 계획:사용 적합성 계획 수립 (다)품질시스템(GMP) 구축:GMP 품질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,특수공정(열균, 포장 등)에 대한 밸리데이션,제품 매뉴얼 작성 (라)위험 분석:위해상황에 따른 위험동제수단 식별,임상 관련 자료 검토,화학적 독성 자료 검토,혼합물 적용 여부 검토,노출 양 및 경로 검토 / 6.시제품 설계,제작,성능평가 (가)시제품 제작:디자인, 설계,시제품 제작 완료 (나)성능평가 준비 및 실시:성능 및 안전성평가 요구사항 확정,시험 관련 자료 준비(원재료 COA 등),(시제품)성능 및 안전성 확인평가 실시 (다)비임상시험 (GLP) 준비:GLP 시험 항목 확정 (라)사용적합성 형성평가:사용적합성 형성평가 수행 (마)품질시스템(GMP) 구축:GMP 품질문서 작성,(프로세스) 위험관리 계획 수립 및 실행,(제품) 위험관리 계획 수립 및 실행,특수공정(열균, 포장 등)에 대한 밸리데이션,제품 매뉴얼 작성 (바)위험 분석:위해상황에 따른 위험동제수단 식별,임상 관련 자료 검토,화학적 독성 자료 검토,혼합물 적용 여부 검토,노출 양 및 경로 검토 / 7.비임상시험(GLP) 안전성 및 유효성 평가(GLP 포함 비임상) (가)의료기기 허가 준비:기술문서 초안 작성 (나)법령 및 규정에 적합한 공인시험성적서 준비 및 확보:생물학적 안전에 관한 자료,성능에 관한 자료,물리화학적 특성에 관한 자료,안정성에 관한 자료 (다)동물실험:유효성 평가 (라)사용적합성 총괄평가 수행:사용적합성 결과 보고서 확보 (마)비임상시험 (GLP) 실시:생물학적안전성 공인 성적서(GLP) 확보 (바)품질시스템(GMP) 인증:GMP 인증 획득,위험관리 보고서 / 8-1.임상시험 (가)임상시험 준비:임상시험계획서 관련 자료 준비,임상시험계획서 작성,IRB 준비,임상시험계획서 신청(임상시험계획서,GMP적합인정서,기술문서에 관한 자료),임상시험계획서 승인,IRB 신청,IRB 승인,임상시험 수행 시작 (나)임상시험 실시 및 종료:시험 모니터링,시험 종료, 종료보고,IRB 종료보고,IRB 결과보고서 승인 / 8-2.인허가/보험등재 (가)의료기기 허가 준비:기술문서 최종안 작성,허가 관련 보고서 검토 및 확보 (이미 허가인증 받은 제품과 비교한 자료,사용목적에 관한 자료,작용원리에 관한 자료,기원 또는 발견 및 개발 경위에 관한 자료,임상시험에 관한 자료,외국의 사용현황 등에 관한 자료) (나)의료기기 허가:의료기기 허가 신청,기술문서 심사,의료기기 허가 승인 (다)신의료기술평가 및 보험:신의료기술평가,보험 등재 / 9.양산](/images/trend/pop-05.jpg)
![[GMP 심사 절차] 2등급 GMP심사 : 심사서류 준비 단계에서 인증신청서+첨부자료(실측치 자료)+품질적합인증서를 준비 후 심사를 진행, 심사 진행 단계에서 먼저 민간기관(8개소)에 기술문서심사의뢰(25일 소요)하여 적합통지서 받은 후 한국의료기기안전정보원에 품목인증신청(5일 소요), 허가 및 판매 단계에서 품목심사 후 허가(인증)서 발급을 받은 후 제조·판매 및 품질관리 / 3,4등급 GMP심사 : 심사서류 준비 단계에서 허가신청서+첨부자료(실측치자료, 임상시험자료)+ 품질적합인증서+(4등급일 경우 STED 관련자료 추가 준비)를 준비 후 심사를 진행, 심사 진행 단계에서 기술문서 포함하여 일괄적으로 품목허가신청(65일 소요)하거나 먼저 기술문서심사의뢰(55일 소요)하여 적합통지서 받은 후 품목인증신청(10일 소요) + 임상시험자료를 포함하여 심사(15일 소요) 진행, 허가 및 판매 단계에서 품목심사 후 허가(인증)서 발급을 받은 후 제조·판매 및 품질관리](/images/trend/2022/confirm_class_img.jpg)